


 552
552
本文作者Jurg M. Sommer等人来自Avigen公司(Avigen在2005年被Genzyme收购,Genzyme在2011年被Sanofi-Aventis收购)。原文“Quantification of Adeno-Associated Virus Particles and Empty Capsids by Optical Density Measurement”发表在MOLECULAR THERAPY Vol. 7, No. 1, January 2003。由于翻译水平有限,详细内容以及“材料与方法”部分,请参考原文。
本文展示了变性的腺相关病毒 (AAV) 载体的紫外吸光度为定量分析溶液中的载体基因组和衣壳蛋白提供了一种简单、快速和直接的方法。我们确定衣壳蛋白的摩尔消光系数在 260 nm 处为 3.72×106 M-1cm-1在280 nm处为6.61×106 M-1cm-1。对于重组 AAV 载体,可以通过包含载体DNA的预测吸光度来计算摩尔消光系数。由于纯化载体制剂中空衣壳的数量以可预测的方式降低 A260/A280比值,纯化的AAV载体制剂中的载体基因组(vector genome, vg)和衣壳颗粒(capsid particle, cp)滴度可以通过260 nm处的吸光度和A260/A280比值计算。为了验证该方法,将通过紫外吸光度计算的vg和cp滴度,与通过定量qPCR 和ELISA(衣壳)确定的滴度进行比较。通过吸光度确定的vg滴度与通过qPCR 确定的滴度非常吻合。通过A260/A280方法测定的cp/vg比率,也与通过AAV衣壳ELISA结合qPCR测定的比率很好地相关。这种新方法提供了一种简单快速的方法来确定AAV的vg滴度和纯化病毒制剂中空壳/全病毒的比率。
关键词:腺相关病毒AAV、紫外分光光度法、摩尔消光系数、qPCR、衣壳ELISA
介绍
基于腺相关病毒(AAV)的载体由于其相对安全性和长期基因表达而在基因治疗中显示出越来越大的前景。近年来,大规模生产用于临床的高纯度AAV的方法有了很大改进。AAV载体产物的定量取决于通过qPCR或点印迹杂交对包装载体基因组的准确测量,这通常是临床使用的剂量定义分析。长期以来,光密度一直用于腺病毒的定量。 Maizel等人根据经验确定了2型腺病毒的消光系数。Mittereder等人以及Sweeney和Hennessey进一步优化了载体变性和光谱学的条件。腺病毒含12-14种不同的蛋白质,其消光系数可能难以一级结构中预测。另一方面,AAV相对简单的结构使我们能够根据三种衣壳蛋白中所含芳香族氨基酸的数量来预测吸光度,结果证实了我们通过氨基酸分析对摩尔消光系数的实验确定。
AAV载体由单链DNA基因组和三个特征明确的蛋白质组成。这些病毒蛋白VP1、VP2和VP3是通过交替剪接从一个开放阅读框衍生而来的。AAV2型的高分辨率结构最近已通过X射线晶体学确定。基于这项研究和其他研究,每个病毒颗粒似乎由5个VP1、5个VP2和50个VP3分子组成,这使我们能够根据已知的VP1、VP2和VP3的已知序列准确预测衣壳蛋白的分子量。通常在AAV载体生产过程中形成的空衣壳在色谱纯化过程中与含有基因组的载体颗粒共纯化,而过量的空衣壳会混淆通过吸光度对载体基因组浓度的简单测定。本文的方法考虑了从A260/A280比值推导出的衣壳比率,进而确定载体基因组(vg)浓度。这种方法产生了一种简单、快速和准确的载体基因组定量方法,在存在多达40倍过量空的衣壳的情况下,检测浓度高于5×1011 vg/ml。我们在此表明,吸光度测定的结果与在 CsCl 密度梯度和柱纯化载体制剂中由qPCR、斑点印迹、ELISA和电子显微镜确定的载体基因组和衣壳值具有很好的相关性。
文章的最后部分,展示了分别用SoloVPE和qPCR/ELISA检测Vigene Bioscience的AAV标准品的数据,对比验证了方法的可行性。
结果
AAV2衣壳蛋白的摩尔消光系数
定量氨基酸分析是确定溶液中蛋白质浓度的准确方法,用于确定蛋白质的摩尔消光系数。我们使用高度纯化的空的AAV2衣壳(命名为 LN 431.92)来确定衣壳的摩尔消光系数。这批AAV颗粒是通过用编码AAV rep和cap基因以及腺病毒辅助功能但没有载体基因组模板的质粒转染 293细胞产生的。在这些条件下,空颗粒被组装起来,并且可以通过柱层析法纯化至均匀。十二烷基硫酸钠-10% 聚丙烯酰胺凝胶电泳 (SDS-PAGE) 证实该制剂没有可检测到的蛋白质杂质,并且在电子显微镜下检测99.6%的颗粒是空的(数据未显示)。氨基酸分析表明氨基酸组成准确反映了 VP1、VP2 和 VP3 蛋白的预测混合物,在每个氨基酸的预期相对量的10%以内。基于每种氨基酸的定量,样品含有 310 μg/mL蛋白质。该样品在280 nm处的平均吸光度为 0.523,A260/A280为0.589。根据这些结果,我们计算了AAV2衣壳的摩尔消光系数(ϵ):ϵ260(capsid)=3.72×106 M-1cm-1和ϵ280(capsid)=6.61×106 M-1cm-1。AAV的已知结构使我们能够使用 ProtPharm软件(Expert Protein Analysis System, Proteomics server of the Swiss Institute of Bioinformatics)预测的变性VP1、VP2 和 VP3的消光系数,根据三种衣壳蛋白的氨基酸序列中发色团的数量来预测吸光度,它基于Gill和von Hippel开发的方程。我们忽略了潜在胱氨酸残基对紫外吸光度的微小贡献,并假设没有影响260或280 nm吸光度的辅基或翻译后蛋白质修饰。该理论方法给出了AAV2衣壳的ϵ280(capsid)=6.23×106 M-1cm-1的值,与实验确定的值相差 <6%。
AAV颗粒变性
我们测量AAV衣壳蛋白UV吸收的方法假定肽段序列中所有芳香族氨基酸的发色基团都对总的UV吸收做贡献。这要求发色团暴露在水性、中性环境中,并且不受一般局部环境或与附近发色团的静电相互作用的干扰。在紫外测量之前载体蛋白的完全变性可确保每个发色基团的最佳吸光度特性,并且对于防止在紫外范围内观察到完整AAV颗粒的瑞利光散射是必要的。我们使用动态光散射来评估AAV颗粒的破坏。在初步实验中确定,即使是相对高浓度的SDS(2%)也不足以在室温或37°C下破坏AAV;然而,在0.05% SDS中加热至75°C保持5分钟会确定导致浓度高达1014衣壳颗粒 (cp)/mL的AAV完全裂解。长达2小时或更高SDS浓度和更高温度的孵育时间不会进一步改变吸光度,这表明蛋白质已完全变性(数据未显示)。在吸光度测量之前,我们选择了0.1%的SDS和75°C下10分钟的条件进行常规样品处理。
特异性、线性和范围
载体吸光度的准确测量取决于合适的载体制剂的空白背景。当在PBS或Tris缓冲盐水中配制时,低至5×1011 vg/mL浓度导致可重复的OD读数。我们观察到至少1013 vg/mL的线性吸光度范围(图1)。残留的蛋白质杂质,以及在UV范围内吸收的赋形剂,如吐温80或牛血清白蛋白(BSA),可能会干扰该测定。然而,这些添加剂通常用于防止材料因吸附到储存容器而损失。作为 Tween 80的替代表面活性剂,我们使用了Pluronic F-68,它在260和280 nm 处没有显示出可测量的吸光度,但在浓度低至0.001 %时可防止由于储存过程中的非特异性吸附和载体操作导致AAV的损失。
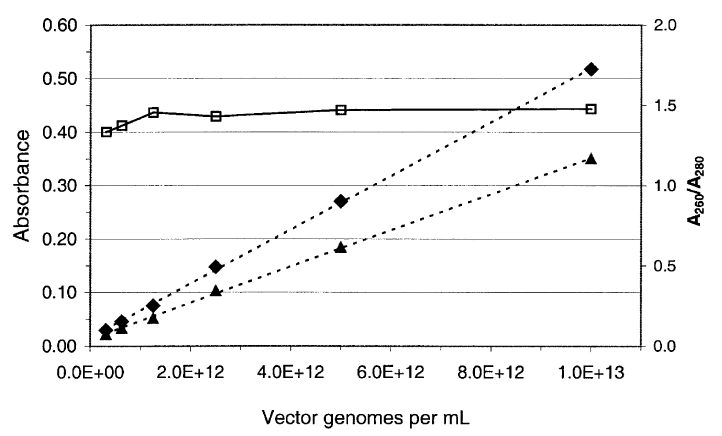
图1. 变性AAV载体的紫外吸光度。将起始浓度为1013 vg/mL的AAV-hFIX16(RVC 257,CsCl密度梯度纯化)等分试样在 PBS 5% 山梨糖醇中稀释为两倍稀释系列,并在0.1%SDS 中在 75°C 下变性10 分钟。在紫外分光光度计中在 260 nm (◆) 和 280 nm (▲)处测量吸光度。没有任何空颗粒的高纯度 AAV-hFIX16 的预期吸光度比为 1.44。在2.5× 1011至1013 vg/mL的定量范围内,观察到的吸光度比 (□)保持相对恒定在 1.42± 0.04 标准误差。
载体基因组浓度
高度纯化的 AAV 制剂的吸光度 (A260) 取决于载体 DNA的分子量和衣壳蛋白的量。本文中描述的所有实验均使用AAV-hFIX16进行,其中包含源自人类凝血因子IX (FIX)的“minigene”,由肝脏特异性增强子和启动子元件控制。载体基因组(MWDNA)的计算分子量为1.33 × 106 g/mol。 AAV载体DNA的正链和负链都以相似的频率包装。我们推断载体基因组在AAV变性后退火形成双链 DNA (dsDNA)。为了检验这一假设,我们在热/SDS处理和室温下孵育20分钟后,通过dsDNA特异性染料PicoGreen对DNA进行了量化。该方法表明dsDNA的量是预期载体DNA量的136 ± 28%,这表明大多数载体DNA确实已经重组成双链。如果不进行热处理,或者在检测等量的单链对照 DNA (M13) 时,PicoGreen 仅检测到10 %到30 %的DNA。因此,我们在该测定中使用dsDNA的消光系数来计算载体基因组。对于仅包含全病毒的样品,衣壳蛋白对 260 nm处的吸光度贡献了12 %,因此通过OD进行的载体量化对少量的空衣壳不是很敏感。在10倍过量的空衣壳中,该蛋白质在260 nm处贡献了60%的吸光度。材料和方法中的公式(6)介绍的用于计算hFIX16的八个AAV载体批次中的A260和A280的vg / mL,结果范围为5.17×1011至1.06×1013 vg/mL。这些结果与通过 qPCR 测定的vg滴度进行了很好的比较,相关系数为0.985,斜率为1.10(图2)。平均而言,通过吸光度获得的载体基因组结果与qPCR 结果相差8.2 %(表1)。其中四个批次的特征还在于斑点杂交,所有三种方法的vg结果之间具有相似的一致性(表 1)。
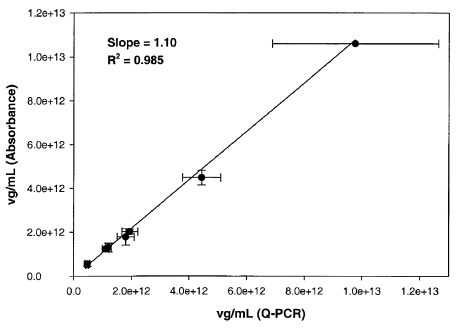
图2. 通过吸光度与qPCR确定的载体基因组浓度的相关性。通过分光光度法分析了8批AAV-hFIX16,其衣壳与载体基因组的比率范围为1到40,滴度范围为4.6×1011 到1×1013 vg/mL。将基于吸光度计算的vg/mL与通过qPCR获得的vg/mL作图。误差线表示重复测定之间的标准偏差。
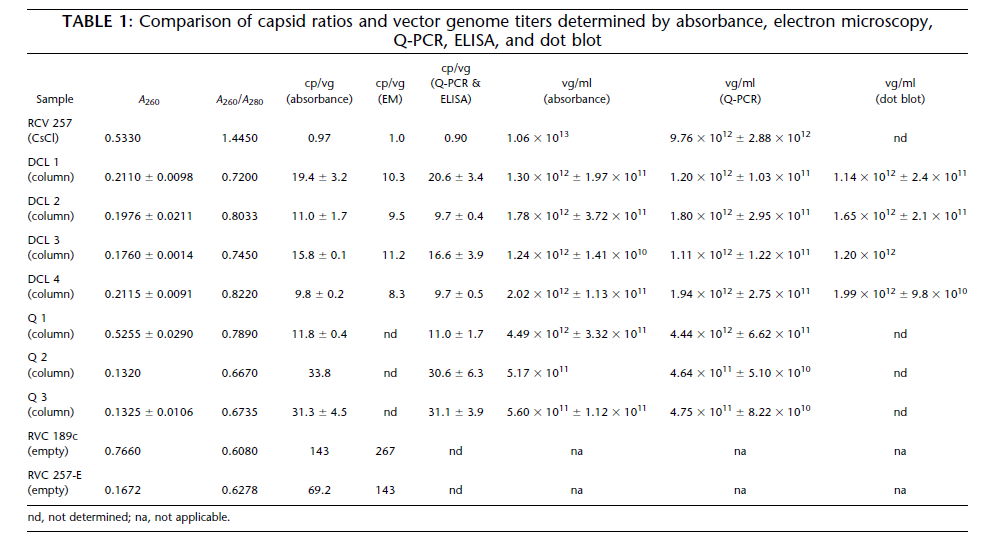
估计载体制剂中的空衣壳含量
基于材料和方法中的公式(4)使用MWDNA=1.33×106 g/mol,制备100%完整AAV-hFIX16 载体颗粒(cp/vg=1) 的A260/A280为1.438,制备100%空衣壳的A260/A280为0.590。对于包含空颗粒和完整颗粒混合物的载体制剂,例如通过柱层析纯化的样品,cp/vg比值可以从观察到的吸光度比中推断出来。图3显示了cp/vg和A260/A280之间的预测关系。曲线的形状表明,吸光度比可用于估计从cp/vg=1(无空衣壳)到大约20的比值。超过这个范围,吸光度比接近纯衣壳蛋白的渐近值(0.590) ,测量空壳比率的准确度下降。我们基于A260/A280确定了八批 AAV-hFIX16载体和两批空壳的 cp/vg比值(表1)。载体样品包括1批CsCl梯度密度离心(RVC 257)和7批柱纯化载体。cp/vg比值也通过ELISA和qPCR测定,结果比较如图4所示。吸光度法正确预测CsCl梯度纯化载体(RVC 257)的cp/vg 比率为1.0,通过电子显微镜分析对比,其空壳颗粒少了1%。该批次通过 ELISA/qPCR 测定的衣壳比率为0.90(表1)。对于七个柱纯化的载体样品,由吸光度确定的cp/vg 比值在10到34之间,与 ELISA/qPCR确定的值非常吻合,相关系数为 0.995,斜率为1.02在这个范围内(图3)。五个AAV-hFIX16批次还通过电子显微镜(EM)进行了表征,通过该显微镜可以计算空壳和全病毒。吸光度结果与 EM 有很好的相关性,但有两个值得注意的例外,DCL 1 和 DCL 3(表1),它们通过EM分析的比率明显低于通过OD或衣壳ELISA的比率。总体而言,载体样品中由EM与OD确定的衣壳比值的相关性 (R2) 为0.96,包括DCL 1和DCL 3。
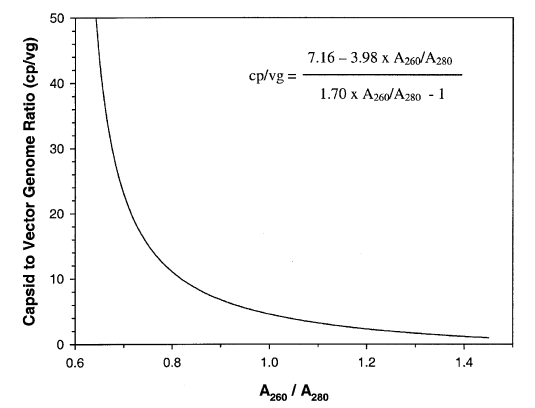
图3. AAV-hFIX16的衣壳与载体基因组比率 (cp/vg)和吸光度比率 (A260/A280) 的预测关系。绘制了重组AAV-hFIX16 载体的理论A260/A280比率,cp/vg 比率范围为1(无空衣壳)至50(98%空衣壳)。
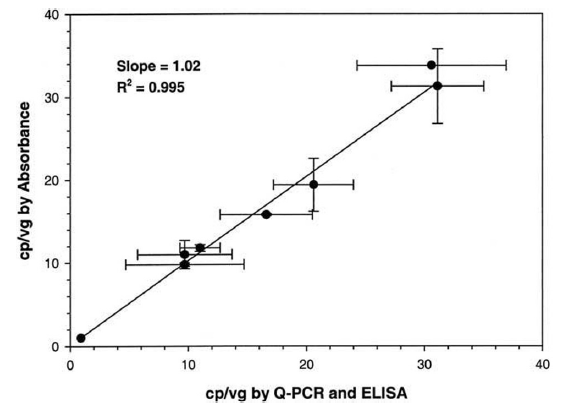
图 4. 比较吸光度测量和qPCR/ELISA以确定衣壳与载体基因组的比率。显示了八个AAV-hFIX16样品的吸光度测量和ELISA得出的cp/vg比率。误差棒表示重复测定之间的标准偏差。
讨论
本文中介绍的测定是一种简单、快速和准确的方法,用于测量纯化的AAV病毒或载体溶液中的衣壳蛋白和载体基因组浓度。该测定不需要标准曲线,并使用的设备在大多数实验室容易获得。此外,该测定提供了总衣壳浓度和特定载体收率,这是AAV制造过程中的重要参数。以前,需要两次测定来独立确定这些参数,这两种方法都相对费力且耗时。
AAV的生物合成和组装导致形成缺乏病毒基因组的空衣壳。空衣壳与全病毒的比例主要取决于要包装的载体基因组的大小和序列,还取决于细胞培养系统和AAV生产和纯化的模式。我们观察到从AAV2野生型细胞收获中的空衣壳不到50%到包装不良的某些重组AAV载体超过 98%的范围。虽然基于密度梯度离心的传统AAV纯化方法将空AAV衣壳从含有基因组的载体颗粒中分离出来,但大多数可扩展的基于层析的载体纯化方法都无法实现这种分离。本文报道的测定AAV衣壳颗粒和载体浓度的吸光度方法适用于密度梯度纯化和柱纯化载体。随着产量和浓度要求的增加以及对可能的载体聚集的担忧出现,了解载体制剂的总AAV衣壳蛋白含量变得很重要 。总体而言,我们的结果表明吸光度测定可以预测衣壳比率。衣壳ELISA和qPCR的组合使用,其中在确定该比率时必须考虑两种测定的累积变异性。
这种方法的一个限制是需要相对高浓度的纯化AAV(>5×1011 vg/mL)。另一个限制是蛋白质或核酸杂质,以及在紫外范围内吸收的缓冲液或赋形剂,会影响结果的准确性。适当匹配的配方缓冲液用作测定空白,可以克服赋形剂的一些影响,但需要独立验证载体纯度。为了测试蛋白质杂质在该测定中的影响,将BSA以一半的衣壳蛋白质量加标到柱纯化载体样品(cp/vg=15)中,用于模拟大约30%的蛋白质杂质。这导致表观cp/vg比值增加了14.5%,并且对vg浓度的影响可以忽略不计。BSA在280 nm处的吸收比AAV衣壳蛋白(按质量)低约2.5倍,观察到的添加BSA的效果与预期的表观衣壳浓度增加20%一致。
本文证明了紫外分光光度法在定量表征特定AAV2衍生载体的载体颗粒和空衣壳方面的有用性。材料和方法下提供的公式可用于计算具有不同基因组分子量的基于AAV2的载体的预期吸光度。相关AAV血清型的衣壳组成略有不同,这可能导致不同的摩尔消光系数。我们基于存放在GenBank的衣壳序列的计算表明,与AAV2血清型相比AAV3(AAB95452) 和AAV6 (AAB95450) 的预测摩尔消光系数在280 nm处将低1%至2%,而AAV5 (AAD13756) 的预测摩尔消光系数将低4.5%本研究中提出。因此,我们预计,当应用于其他AAV血清型时,吸光度测定只需要稍作修改。



