


 505
505
原文要点
制备色谱的各个步骤使用PAT监测;
可变光程的紫外/可见光谱用于入线测量,测量的蛋白质浓度达75 g/L;
通过偏最小二乘回归法(PLS)进行蛋白质的选择性定量;
通过PLS模型的计算来控制纯化步骤。
摘要
在蛋白质制备色谱中,蛋白质浓度的宽动态范围,以及产品和杂质的共洗脱现象是很常见的。尽管制备色谱是生物制药生产的标准,但对其监测通常使用的是替代信号,如280nm处的紫外吸收。为了解决这个问题,可变光程(VP)光谱与偏最小二乘回归法(PLS)相结合,被用来监测制备色谱。本研究中,该方法先是用于监测溶菌酶(Lys)与细胞色素c(Cyt c)在92 g/L的总装填密度下的分离。然后,同样的方法被应用于单克隆抗体(mAb)在40 g/L装填密度下的抛光步骤。对于mAb单体和高分子量变体(HMWs)的PLS模型预测,均方根误差(RMSE)分别为1.07 g/L和0.42 g/L。总之,VP光谱与PLS建模相结合,是未来大规模入线监测和控制色谱步骤的一个有前途的选择。
介绍
在当前的生物制药纯化过程中,制备液相色谱法是从含培养基成分、DNA、宿主细胞蛋白质和产品相关杂质中分离出目标产品的关键。使用这种方法是因为它的高分离能力,同时还可更大限度地减少产品损失。
制备色谱过程通常在高装填密度下运行,以实现高效过程。高的装填密度随后会导致从柱上洗脱的蛋白质馏份的浓度范围很广。因此,监测技术必须具有很宽的动态范围,以捕获峰值浓度以及峰侧较低浓度的杂质。此外,由于制备色谱的分辨率有限,产品和杂质之间的基线分离很难实现。因此,PAT技术应选择性地量化产品和主要杂质。由于色谱法的快速变化,色谱法过程中的决策时间是很有限的。
目前有许多不同的文献方法被用于了色谱的实时监测。制备色谱的在线监测和控制,已通过高效液相色谱自动取样和后续分析实现。制备液相色谱中的宽浓度范围可以通过改变进样量来轻松控制。但缺点是,由于样品处理和分析时间以及污染风险的影响,会造成时间的延迟。
此前,紫外/可见光谱已被提议作为色谱过程入线监测的方法。它对模型蛋白质的多组分混合物和实际分离问题都很有用。为了增加光谱采集的动态范围,设计出了新的测量池,它允许连续改变光程的长度,以实现几乎任何分析物的浓度,并具有理想的灵敏度。这种方法与PLS建模相结合,成功地用于监测废水的化学需氧量。该方法由一家商业供应商进一步开发,用于了蛋白质的相关应用,可以在广泛的浓度范围内测量蛋白质光谱,测得的蛋白浓度可达250 g/L。最近,有供应商又推出了一条用于入线可变光程(VP)测量的产品线。该设备能够提供高达约80 AU/mm吸光度的测量结果,对应于近600 g/L的mAb浓度。
本研究展示了通过UV/Vis 可变光程光谱结合PLS建模对制备色谱进行入线监测。VP光谱可以在几乎任意的蛋白质浓度下监测色谱过程,且PLS模型可以从光谱数据中选择性地量化多个共洗脱组分。本研究中,该方法先是用于在高装填密度下分离模型蛋白:溶菌酶(Lys)和细胞色素c(Cyt c)的混合物。前者是产品,后者是污染物。
随后,使用该方法监测了mAb单体及其HMWs的制备抛光步骤。为了证明这种方法在过程控制方面的有效性,根据模型系统的洗脱蛋白的预测浓度或单抗的计算纯度,对这两个分离案例中的产品池进行了入线控制。
材料和方法
色谱仪器
制备色谱实验均是在配有样品泵S9的ÄKTA Pure 25系统上进行。另外,使用FlowVPE可变光程的紫外/可见分光光度计(C Technologies, Bridgewater, USA)监测色谱柱的流出物,它被整合到AKTA系统的电导率监测器和分数集电器之间的流程中。使用Dionex UltiMate 3000快速分离液相色谱系统对收集到的馏分进行分析。
可变光程色谱
FlowVPE可变光程光谱仪使用一根可移动的光纤来改变流通池的光程L(图1)。一个可变光程的测量周期包括一个筛选阶段和一个随后的采集阶段。在筛选阶段,根据在280 nm处的5、25、100 μm三个光程的3次测量值,仪器会计算出采集阶段的更佳光程。
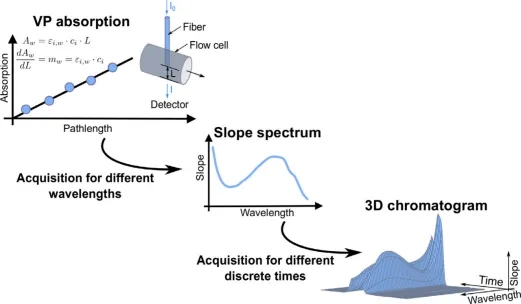
图1可变光程光谱法:每个测量周期,通过驱动FlowVPE的光纤来实现可变的光程L。在确定更佳测量光程的筛选阶段结束后,仪器会测出5个不同光程的紫外吸光度。接着计算每个波长的斜率,给出一个斜率值。然后产生一个三维的(时间,波长,斜率)的色谱图。
在采集阶段,仪器于五个不同的光程位置上测得对应的吸光度Aw,i(i取值在{1,2,3,4,5};w为选定的波长)。基于郎勃-比尔定律,假设吸光度估计值Ãw与光程L之间存在线性相关(公式(1))。那么,通过公式(2)中的最小二乘问题,可以估计出斜率mw和截距bw。
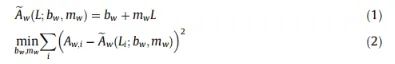
由于斜率是在整个色谱运行过程中得出的,而且实验结果是由时间、波长、斜率确定的,因此它是一个三维的色谱图。通过等式(1)和郎勃-比尔定律,可以导出以下等式(3)。

这表明,斜率与蛋白质浓度C、消光系数ew相关。由于只考虑斜率,因此光纤的偏移对最终结果没有影响。一般来说,对于中紫外光谱的测量时间大约需要30秒。
实验案例
文章研究了Cyt c与Lys的分离、从mAb单体中分离HMWs两个案例,实验详细步骤见原文。
结果与讨论
如实验所述,在两个案例研究中都进行了不同光程下的线性梯度测量,以得到不同的混合比和被检测蛋白质的浓度。
可变光程光谱法在色谱分析中的应用
在可变光程光谱法中,仪器在不同的光程下测量吸光度。图2A为280 nm处的典型色谱图。绿线表示不同光程下随时间变化的吸光度。相应的光程用灰色线表示。用橙色表示随时间变化的斜率。如图等式(3)所示,斜率与总蛋白浓度呈线性关系。值得注意的是,在蛋白质洗脱过程中,吸光度值几乎保持不变,而光程则减少。在筛选阶段,选择测量阶段的更长光程,使其在280 nm处的吸光度约为1 Au。因此,设置的光程与斜率是成反比的,从而它也与蛋白质浓度成反比(图2A)。
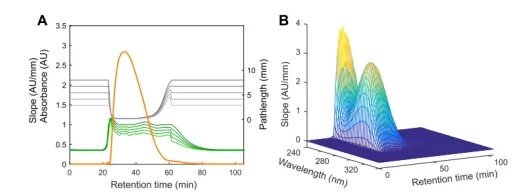
图2 用VP波谱得到的单波长(A)和多波长(B)的典型色谱图 A: 绿线表示在不同光程处获得的吸光度值(灰线)。在每个时间点,斜率(橙色线)由5个吸光度值和光程之间的线性确定。B: 如果在色谱运行过程中记录斜率,则得到三维色谱图。
图2A显示了一个波长的典型色谱图,而图2B显示了多个波长的色谱图。它们不是单波长的斜率,而是斜率光谱。由于斜率是在整个色谱运行过程中产生的,这导致得出了在(时间、波长、斜率)处的三维色谱图。所得到的三维色谱图是PLS模型校准和确认的起点。
案例1:Cyt c与Lys的分离
由于芳香族氨基酸的质量分数以及Cyt c中血红素基团的不同,Cyt c和Lys的紫外光谱存在显著差异(图3A)。
在交叉验证的基础上,选择2、3个潜在变量的Lys和Cyt c。三次校准运行(梯度长度为2、4和8 CVs)的PLS模型预测结果如图4A、B和D所示。这些图将Lys(蓝色实线)和Cyt c(红色实线)的PLS模型预测与相应的参照结果(蓝色条为Lys,Cyt c)进行了比较。在所有校准运行的PLS模型预测和参考模型之间都有很好的一致性。
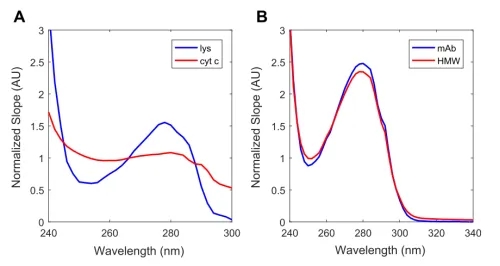
图3 案例研究I(A)和案例研究II(B)的蛋白质斜率的比较。
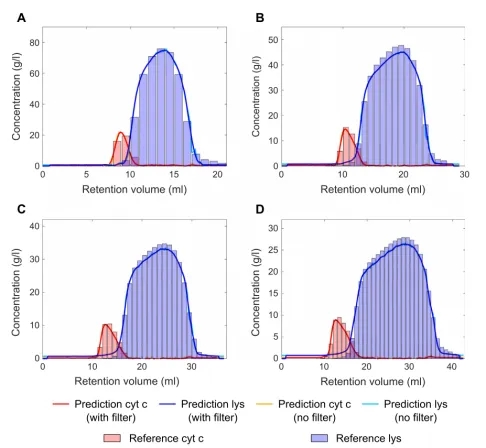
图4 将lys和cyt c的PLS模型预测与(A)2 CV、(B)4 CV、(C)6 CV和(D)8 CV梯度长度的离线参照结果进行比较。PLS模型预测的蓝色和红色阴影说明了平滑的效果。
为了确认该模型,我们对6 CV梯度运行进行了预测,并密切遵循相应的参照(图4C)。图4中PLS模型预测的不同蓝色和红色阴影说明了非平滑和平滑数据(非平滑数据颜色较浅,平滑数据颜色较深)。Cyt c的RMSE为0.53 g/L,Lys为1.11 g/L。使用Savitzky-Golay滤波器的平滑预测数据,Cyt c 的RMSE为0.48 g/L,Lys为1.05 g/L。应用Savitzky-Golay滤波器明显改善了预测Lys和Cyt c的RMSE(表1)。
VP光谱和PLS模型的结合允许在色谱柱中选择性定量Lys和Cyt c,峰浓度高达80 g/L。说明该方法适用于制备色谱的典型浓度范围。
案例2:从mAb单体中分离HMWs
与Cyt c和Lys相比,mAb单体和HMWs可能含有相同质量分数的芳香族氨基酸和二硫键桥。因此,光谱的差异要么与三级结构的变化有关,要么与光散射有关。因此,mAb单体和HMWs的光谱差异相对较小(图3B)。这使得通过PLS建模的量化更具挑战性。
在交叉验证的基础上,mAb单体采用4个潜在变量的PLS1模型,HMWs采用8个潜在变量的PLS1模型。图5A、C、D显示了三次校准运行(梯度长度为4、6、7 CVs)的PLS模型预测,而图5B显示了确认运行的结果(5 CV梯度)。图中显示了mAb单体的PLS模型预测(实蓝线)和HMWs(实红线)与参照结果(蓝条为mAb单体,红条为HMWs)的比较。在所有四次运行中,模型预测与参照非常匹配。结果表明,该方法对蛋白质的适用性,在吸收光谱上只有轻微的差异。mAb单体的预测RMSE为1.26 g/L,HMWs的预测RMSE为0.50 g/L。通过使用Savitzky-Golay滤波器平滑数据,可以进一步降低RMSE。这使得mAb单体的RMSE值为1.07 g/L,HMWs的RMSE值为0.42 g/L。图4比较了所有运行的非平滑数据和平滑数据。应用Savitzky-Golay滤波器改善了预测mAb单体和HMWs的RMSE(表1)。
入线池化决策
为了显示VP光谱学与PLS建模的有效性,把所实施的方法用于了过程决策。在这两个案例研究中,对色谱运行都进行了带有过程干扰的池化决策。
收集到的池通过离线检测进行分析,都可以做出准确的预测,但会有微小的偏差。对于Cyt c和Lys的分离,预测其纯度为99.0%,而离线分析测定的纯度为99.7%。对于mAb单体产品池,PLS模型预测的纯度为94.4%,而通过离线分析测量的纯度为94.2%。在这里,Savitzky-Golay滤波并没有使预测得到改进,这是因为测量噪声会随着时间的推移而自我抵消(表2)。
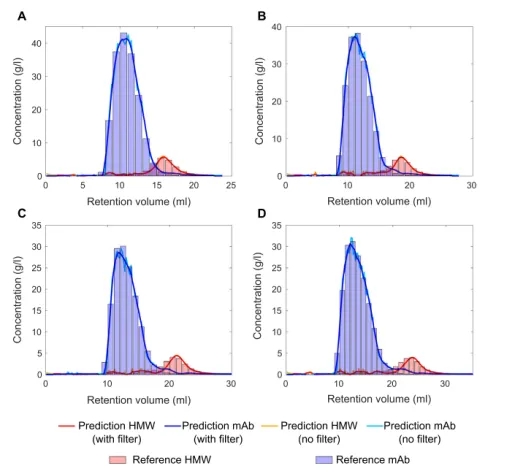
图5 将mAb单体和HMWs的PLS模型预测与(A)4 CV、(B)5 CV、(C)6 CV和(D)7 CV梯度长度的离线参照结果进行比较。PLS模型预测的蓝色和红色阴影说明了平滑的效果。
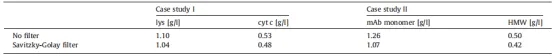
表1 RMSE表示两个案例研究的确认运行中的预测:将未过滤预测的RMSE与过滤数据的RMSE进行比较。
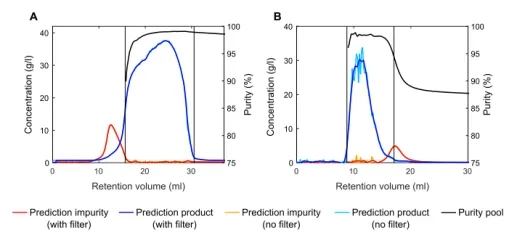
图6 在案例研究I(A)和案例研究II(B)的入线对照运行中,PLS模型预测的蓝色和红色阴影说明了平滑的效果。根据非平滑的数据,计算出池的纯度(黑色)。这些细的黑色竖线表示池化的开始和结束。

表2 对于这两个案例研究,基于PLS模型预测纯度,并与离线分析的相应结果进行比较。
以上结果表明,该方法可用于色谱系统的入线控制。使用的保留时间为10min,高于工业标准。在洗脱过程中降低流速是合理的,因为洗脱阶段相对于整个过程相对较短。另外值得注意的是,这里所讨论的方法要比文献中提出的在线HPLC PAT方法要快得多,因为在生产规模中,在线HPLC的响应时间减慢了约2.5倍到3倍。
结论与展望
本研究成功地实现了制备色谱法的入线监测。研究表明,可变光程的紫外/可见光谱和PLS模型的结合,允许在很宽的浓度范围内入线进行蛋白质的选择性定量。该方法还可以监测高装载色谱柱的运行,产品峰值浓度在30 g/L至80 g/L之间变化,而污染物峰值浓度为4 g/L至20 g/L。总之,该方法具有对制备色谱法的入线监测和控制的潜力,它也可以适用于连续色谱法中对时间切换的控制。



