发布日期:2024-08-30 14:20:23
浏览量
:919
准确测定药品和药品中的寡核苷酸的含量,对确保生产质量和患者的安全至关重要。随着目前反义和短干扰RNA(siRNA)治疗的研究活动呈指数级增长,需要一种可靠的方法来准确地定量给药溶液。生产产品的规模从毫克到公斤不等。如果定量方法不准确,除了由于剂量不正确而危及患者的安全外,还可能由于不准确的产量信息而产生经济影响。由于寡核苷酸的吸湿性和静电性质,重量测量不适用于微量的样品。测定寡核苷酸浓度的常规方法通常依赖于紫外吸收度的测量,这与分子的一个基本性质有关。摩尔消光系数,也称为摩尔吸收率ε,是一种测量化学物质在给定波长下吸收光的强度。这是物质的固有属性;根据比尔-兰伯定律,样品的实际吸光度A取决于路径长度l和物种的浓度CA = εCl
寡核苷酸的摩尔消光系数是一种独特的物理性质,由其序列、温度、pH值和其溶解的缓冲液或溶剂的性质决定。虽然在最大值处的摩尔消光系数更准确,一般来说,一个寡核苷酸的消光系数是在波长为260 nm,即ε260。光密度(OD)是核酸化学家使用的一个较古老的术语。光密度单位,或更常见的是OD,或者OD260,是寡核苷酸的吸光度测量。由于核酸链上的共轭双键体系,核酸链中的每个碱基在260纳米处或附近具有吸光度。因为确切的碱基序列和组成是已知的,OD260单位是一种非常准确和方便的测量方法来定量寡核苷酸。OD260单位是一个归一化的测量单位,定义为使用1.0 cm光程长度的比色皿在1.0 mL溶液中获得260 nm处的吸光度值为1所需的寡核苷酸量。例如,考虑一个分子量为14303.6 g/mole的双链siRNA,其摩尔消光系数为296843 M-1cm-1。使用A = εCl的关系,以及在1.0 mL溶液下的吸光度读数为1.0,OD260相关内容如下:nmole/OD260 = (1/296843)*106= 3.4
μg/OD260 = 14303.6*(1/296843) = 48.2
组合化学方法的快速发展导致了大量适合治疗使用的序列。这种活性需要快速计算消光系数和其他热力学参数来设计寡核苷酸。由寡核苷酸生产商、大学和卫生机构开发的几种基于网络的计算器可供研究人员使用。本章将回顾消光系数的理论计算的来源,并为直接测定寡核苷酸的消光系数提供实验细节。
计算值与实验值
在药物发现阶段,从互联网工具中获得的ε260 计算值是令人满意的,因为在这一阶段,最常见的是对各种寡核苷酸序列的活性进行排序,而没有必要对寡核苷酸进行绝对定量。一旦寡核苷酸进入临床前和临床开发阶段,准确确定配料溶液中的寡核苷酸浓度至关重要。药物产品的 "标签声称 "应通过可靠的分析方法确定,以符合预先确定的规格限制。关于计算值与实验值 ε260 之间差异的影响说明如下。
这种合成的双链 RNA 寡核苷酸是由两条部分互补的单链 RNA 杂交而成。每条单链 RNA 都由 19 个核糖核苷酸和 3′端的两个胸苷单位组成。其中一条链上的 19 个核糖核苷酸与另一条链上互补的 19 个核糖核苷酸杂交,从而形成 19 个核糖核苷酸对和双链两侧的双胸苷悬垂。有义链和反义链的组成如下:Sense: 5′ - GGC UCU UAG CAA AGU CAA GTT - 3′
Antisense: 5′ - CUU GAC UUU GCU AAG AGC CTT - 3′
经实验测定,有义链在水中的ε260为 183 100 (M-1cm-1)。使用 OligoAnalyzer 3.118 的计算值为 209700(M-1cm-1),比实验测定值高 14.5%。使用 Ribotask 方法计算出的有义链计算值为 220,600 (M-1cm-1),比实验测定值高 20.5%。对于水中的反义链,实验测定的 ε260 值为 168,300 (M-1cm-1)。
使用 OligoAnalyzer 3.118 对反义链的计算值为 197,800 (M-1cm-1),比实验测定值高 17.5%。使用 Ribotask 对反义链的计算值为 209,100 (M-1cm-1),比实验测定值高 24.2%。其他几种网络工具也可以对计算值和实验值进行类似的比较。
上述比较清楚地表明了各种计算方法得出的计算值与直接测定值之间的差异。为了用单链构建双链,必须确定单链的摩尔浓度,而且必须小心地制作已知摩尔比的混合物。如果根据不同网络工具的计算值进行计算,可能会影响 siRNA 双链的质量。此外,根据错误计算得出的药物制剂最终浓度可能不准确,无法满足标签声明的规格要求。
消光系数的直接测定
各种基于网络的寡核苷酸计算器提高消光系数计算精度的迭代过程取决于单核苷酸磷酸酯消光系数的准确测定。然而,随着用于 siRNA 治疗的各种嵌合 DNA-RNA 序列迅速增加,在线计算器无法确定所有消光系数。即使是消光系数的近似估计值,与真实值相差 10-20%,也会对毒理学安全性数据的结论产生严重影响,并导致临床用药方案的计算错误。这种计算错误还会导致以公斤为单位合成寡核苷酸的产量结果不准确,也会导致成品成本大幅增加。
因此,建议直接测定将用于毒理学和临床研究的前导序列的消光系数。如下所述,直接测定不依赖于单核苷酸二核苷酸磷酸盐的单个消光系数值。不过,直接测定不需要对样品进行长时间的水解;应合成最高纯度的参考标准并用于ε260测定。
1. 实验步骤
在湿度控制手套箱中称取 20.0 ± 2.0 mg冻干寡核苷酸。定量转移到 100 mL A 级容量瓶中,并溶解在 0.9%的生理盐水中。在称量样品进行 ε260 测定时,必须同时测定水分含量(采用Karl-Fisher法)。样品中过量的盐分也会影响样品重量。因此,建议在称量样品进行 ε260 测定的同时,称量另一个样品进行钠分析。对称量出的样品进行水分校正。如果钠含量没有明显高于钠的理论值,则无需校正过量的钠含量。计算该储备溶液的浓度(约 0.2 mg/mL)。进行稀释(n = 5),使校准标准的吸光度读数介于 0.3 和 1.2 之间(见表 12.2 中的样品稀释方案)。将紫外仪器的温度设置为 25°C。
至少 30 分钟后,确认紫外仪器在 260 nm波长处的光度精度。对每种校准溶液进行一式三份的测量,并绘制平均读数与校准标准浓度的对比图。紫外吸光度与浓度的校准图的斜率即为 ε260 的值,单位为mole/L。一式三份进行上述ε260 的测定,取平均值得到ε260 的最终值。
2. 通过直接测量计算 ε260 的示例
称取分子量为 14303.6 g/mole、含水量为 3.03% 的 siRNA 双链体,一式三份,溶于 100 mL 0.9% 生理盐水中。一式三份,溶解在 100 mL 0.9%生理盐水中。对于Replicate 1(见表 12.2),经湿度校正的样品重量为
= 19.02*(100 - 3.03)/100 = 18.444 mg
= 18.444 mg*(g/1000 mg)*(1/100 mL)*(1000 mL/L)*(mole/14303.6 g)
= 1.29E-05 M
进行连续稀释(n = 5),在 260 nm、25°C 和色度计比色皿路径长度为 1.0 cm处测量吸光度,一式三份。第一份样品 1 的原液稀释为 5 mL 加入 100 mL。稀释后溶液的浓度为= (5/100)* 1.29E-05 = 6.45E-07
该溶液的平均吸光度测量值(n = 3)为 0.1945 AU。有关三个称重重复的五个稀释度的完整数据集,请参见表 12.2。根据数据的斜率计算出 siRNA 在 260 纳米波长处的消光系数;每个重复品的五个测量值的校准图见图 12.2。三个重复品的斜率分别为 297,342、298,092、 295,095,摩尔消光系数的平均值为 296,843 M-1cm-1,相对标准偏差为 0.5%。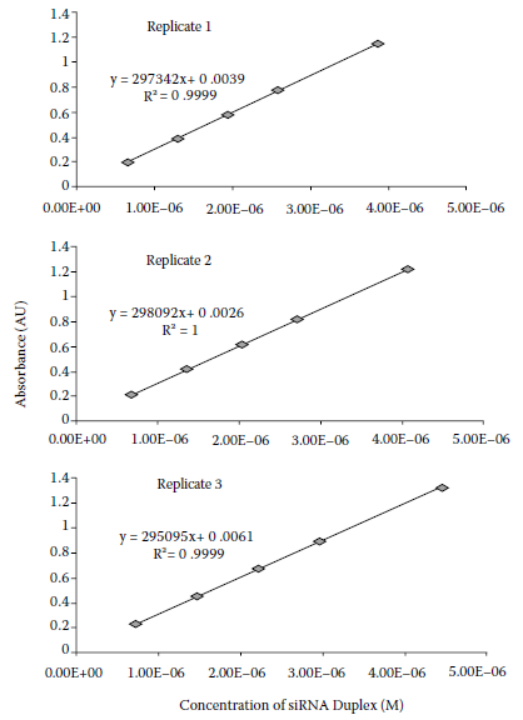
Fig 12.2 三份摩尔消光系数测定值的校准图
总结
本章将帮助读者评估是否需要通过实验确定消光系数。本章举例说明了各种计算值与实验测定值之间的差异,还提供了直接测定 siRNA 寡核苷酸摩尔消光系数的详细实验步骤。
——节选自《Handbook of Analysis of Oligonucleotides and Related Products》



 919
919





